Sistem: dapat berupa suatu zat atau campuran zat-zat yang dipelajari
sifat-sifatnya pada kondisi yang dapat diatur.
Segala
sesuatu yang berada diluar sistem disebut lingkungan.
Antara sistem dan lingkungannya dapat terjadi
pertukaran energi atau materi.
§ Sistem tersekat : sistem
dan lingkungan tidak dapat mempertukarkan energi maupun materi. Sistem dengan
energi tetap, walaupun didalamnya dapat terjadi perubahan energi dari satu
bentuk ke bentuk yang lain.
§ Sistem tertutup : sistem
dan lingkungan hanya dapat mempertukarkan energi.
§ Sistem terbuka : sistem
dan lingkungannya dapat mempertukarkan baik energi maupun materi.
Suatu sistem dalam keadaan tertentu apabila semua
sifat-sifatnya mempunyai harga tertentu dan tidak berubah dengan waktu.
Keadaan sistem ditentukan oleh sejumlah variabel
atau parameter sistem, misalnya suhu, tekanan, jumlah mol, volum, komposisi
dsb.
Variabel yang harganya hanya tergantung pada
keadaan sistem dan tidak tergantung pada bagaimana keadaan itu tercapai disebut
fungsi keadaan.
Contoh : suhu, tekanan, volum, energi dalam dan
entropi
V = f (P, T, n).
Diferensial dari suatu fungsi
keadaan adalah diferensial total. Bila x adalah fungsi keadaan maka dx sebagai diferensial
total.
1.
∫dx = x2 – x1
1
2. ∫ dx = 0
3. x = f (y, z)
dx = (∂x/∂y)z dy + (∂x/∂z)y dz.
Hukum
Pertama Termodinamika
Proses :
Reversible dan tidak
reversible.
Proses reversible:
H2O(l)
H2O(l)
 |
| 1 atm, 1000C |
1. Pl
= 0 : gas memuai terhadap vakum
W = 0 à proses ekspansi bebas
2.
Pl
tetap à gas memuai pada tekanan atmosfir yang tetap.
V2
W = - ∫ Pl dV = - Pl
(V2 – V1)
V1
W = - Pl ΔV
3. Proses
pemuaian reversibel : Pl =
P – dP
Untuk proses yang berjalan pada Volume tetap, maka harga ΔU = qv
Enthalpi dan Perubahan Enthalpi
Reaksi kimia berjalan pada tekanan sistem yang tetap dan sama dengan tekanan
luar.
CV : kapasitas
panas pada volum tetap.

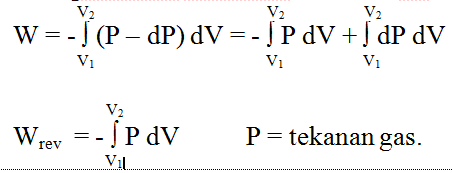






Tidak ada komentar:
Posting Komentar